肿瘤作为一种具有高度异质性和侵袭性的复杂疾病,已成为全球严重威胁人类健康的重大公共问题,多种治疗方式的联合应用已成为肿瘤协同治疗的一种有效方法,一种典型的协同策略包括光热疗法(PTT)、热动力疗法(TDT)和化疗(CT)相结合。尽管该方法显示出了良好的治疗效果,但两个关键的局限性仍然阻碍了它们的临床应用:(1)近红外光穿透有限和加热不均匀:目前的光疗法依赖于外部激光照射,但近红外光穿透较浅导致加热不均匀,将热效应限制在浅表肿瘤区域。增加功率会破坏表面组织,进一步降低穿透性,并且几乎不可能在24小时内重复治疗。这种热不一致也会损害动力学治疗中活性氧自由基(ROS)的产生,从而影响整体疗效。(2)各治疗模式间的时间和强度协调性差:光热效应仅持续几分钟,热动力治疗持续数小时,化疗需要持续20小时以上才能达到有效药物浓度。因此,各种治疗的强度会随时间波动,形成“峰谷”模式,让肿瘤细胞能够恢复抵抗,极大地影响了疗效。克服上述障碍需研发新的光疗设备、协同策略和具有精确时空控制的智能药物递送系统,以确保协调、持续和高效的肿瘤治疗。
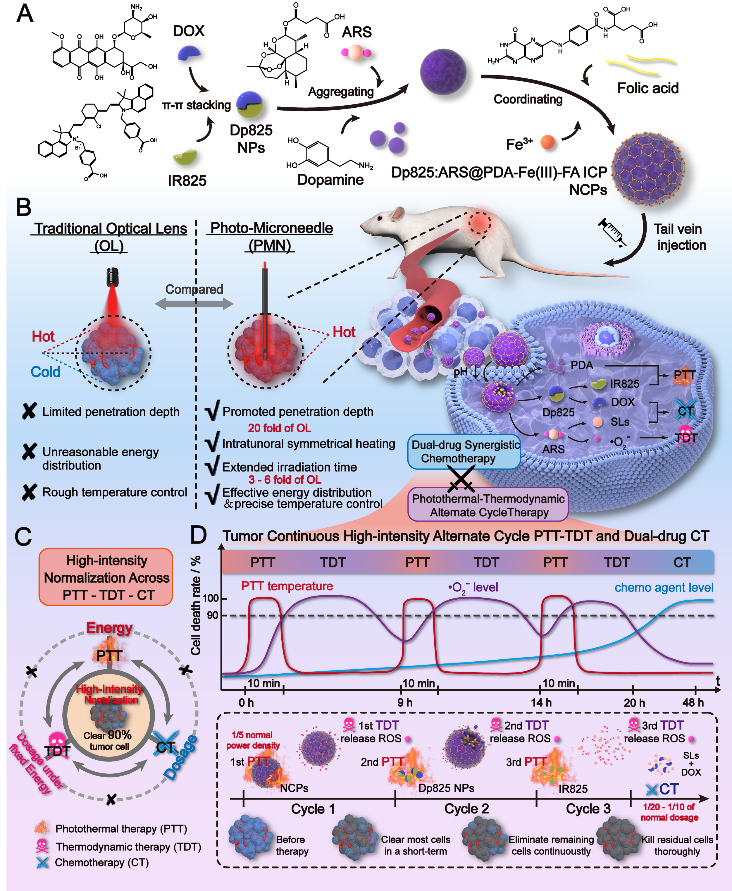
图1 肿瘤连续高强度光热-热动力交替循环治疗-化疗的策略和递送系统
针对以上问题,西安交通大学生命学院生物医学影像与应用研究所吴道澄教授团队设计了新的光疗设备,提出了连续高强度光热-热动力交替循环治疗结合化疗的协同治疗新策略,设计、制备了分子堆砌@无限配位聚合物纳米复合材料实现了该策略。
为了克服传统光热疗法的局限性,团队研发了一种光微针(Photo-microneedle,PMN),将光纤穿过多孔不锈钢微针,当其插入肿瘤组织时,激光从尖端和侧壁发射,使肿瘤内照射均匀。与传统的光学透镜不同,PMN将能量直接输送到肿瘤核心,可改善温度控制、提高能源效率,最大限度地减少对健康组织的损害有利于可重复的光热-热动力治疗周期。与光学透镜相比,PMN的穿透度增加20倍,只需1/5的激光功率即可达到治疗温度并确保均匀的温度分布,支持20小时内三个10-15分钟的光热治疗周期。
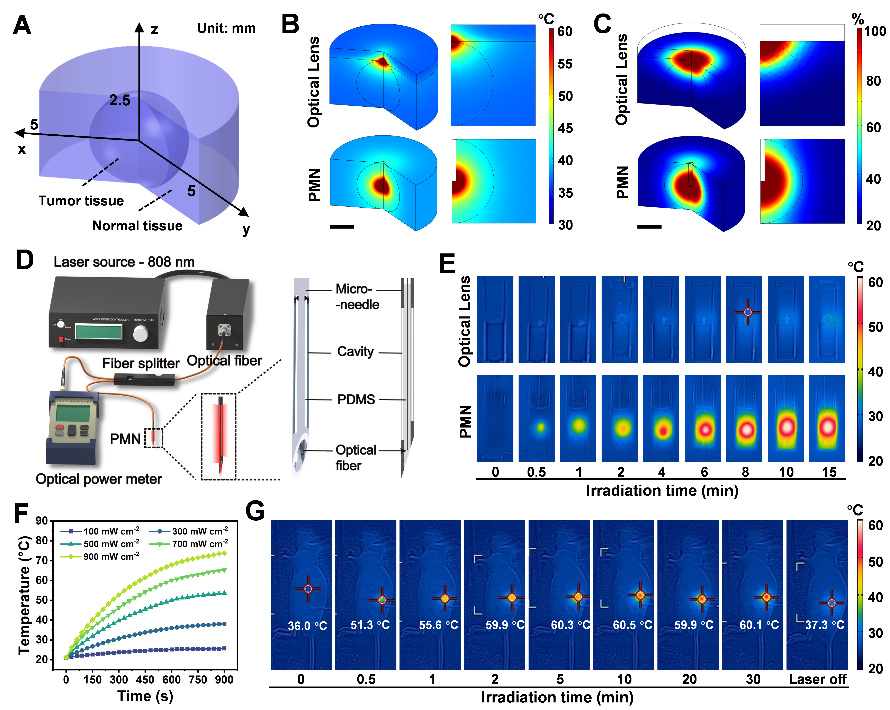
图2 光微针的设计、仿真与实验验证
为了解决治疗方式之间随时间强度协调不一致的问题,团队引入了肿瘤细胞死亡作为共同参考,将高强度治疗定义为杀死90%肿瘤细胞所需的最低能量、ROS水平或药物剂量。基于此,团队设计了一种48小时肿瘤连续高强度光热-热动力交替循环治疗和化疗策略:前20小时有三个光热-热动力交替循环(分别持续9、5和6小时)来确保持续的高治疗强度。20小时后,双药浓度达到高强度水平,再继续24小时的持续化疗。这48小时的治疗窗口维持了不间断的高强度治疗,大幅度增加了疗效、降低了肿瘤耐药风险。
为实现上述策略、使协同治疗更有效果,团队将IR825和阿霉素(DOX)自组装成核心纳米粒子(Dp825 NPs),然后将其封装在装载有青蒿琥酯(ARS)的聚多巴胺(PDA)-铁(Ⅲ)-叶酸(FA)无限配位聚合物(ICP)外壳中,形成纳米复合材料(Dp825:ARS@PDA-Fe(Ⅲ)-FA ICP NPs)。该系统能够对药物释放进行精确的时空控制,满足上述协同策略的要求,以最小的能量和药物使用实现了连续48小时的高强度治疗。与PMN系统的集成可确保精确的肿瘤内能量输送和有效的治疗激活,显著提高了治疗精度和疗效,同时降低了全身毒性。在体内仅使用300 mW·cm-2的激光功率(传统光学透镜的1/5)和5.0 mg·kg-1的低注射剂量(标准DOX或ARS单药治疗的1/10-1/20),可完全根除大肿瘤(~300 mm3)且能维持60天无复发。本研究为精确引导、低毒性和高效的多模式肿瘤治疗建立了有效的治疗平台。
该工作以《用于肿瘤连续高强度光热-热动力交替循环治疗和化疗的分子堆砌@无限配位聚合物纳米复合材料》(“Molecular stacking@infinite coordination polymer nanocomposites for tumor continuous high-intensity photothermal-thermodynamic alternate cycle therapy and chemotherapy”)为题在著名期刊《美国化学会·纳米》(ACS Nano, IF=16.0)上在线发表。文章第一作者为西安交通大学生命学院博士生赵晨宇,西安交通大学生命学院为该论文的第一和通讯作者单位,吴道澄教授为唯一通讯作者。
该工作得到了国家自然科学基金,陕西省自然科学基础研究计划等的资助。西安交通大学分析测试中心和生物医学实验中心为本工作提供了大量研究支持。
论文链接: https://doi.org/10.1021/acsnano.5c07772