合成细胞器的发展旨在模拟细胞内多区室化结构与通讯机制,在生命规律解码、疾病诊疗、以及智能材料开发等领域具有广阔应用前景。然而现有合成细胞器(如脂质囊泡和聚合物组装体)由于缺乏天然细胞骨架蛋白的支撑与动态调控,普遍存在结构稳定性不足、适应性反馈机制缺失等问题,制约了自主通讯网络的构建。
针对上述挑战,西安交通大学赵永席教授团队提出了一种模块化、可编程的DNA纳米笼策略,突破了合成细胞器在机械稳定性与跨膜转运能力之间的权衡难题,实现了仿生细胞器网络的自适应时空重组与精确信号调控。研究团队以细胞外囊泡(EVs)——天然分泌的纳米级脂质囊泡——为模型系统,将四面体DNA框架结构(TDNs)锚定于EV膜表面,通过基于回文的杂交链式反应(PHCR)招募DNA发夹,在EV表面组装形成DNA纳米笼。机械强化的DNA纳米笼封装显著增强了区室化单元的稳定性,有效抑制了膜接触过程中的囊泡融合现象,同时能够维持区室内外良好的通透性。进一步利用DNA纳米技术在智能反馈调控设计中的独特优势,DNA笼的模块化设计允许整合逻辑门控DNA元件作为动态接触位点,实现区室间的适应性时空重组,并精确微调区室间信号通讯。这项工作为构建具有自适应反馈机制的仿生细胞器及实现复杂的细胞器样行为奠定了基础。
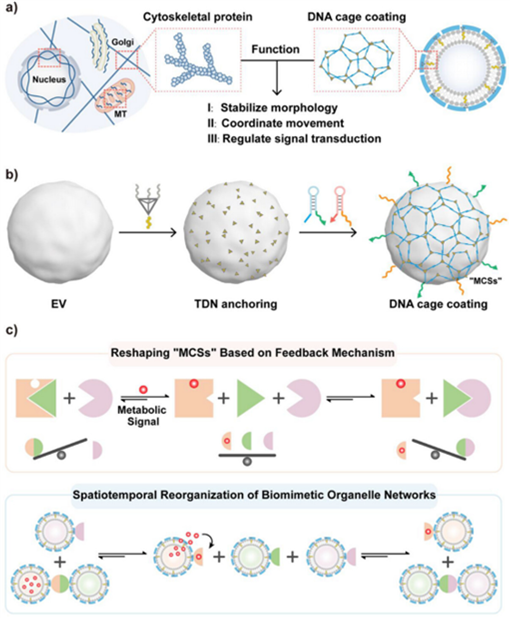
自适应仿生细胞器网络系统的构建。a) 膜表面DNA纳米笼组装结构的仿生功能示意图。b) 细胞外囊泡(EVs)膜表面的DNA纳米笼封装。c) DNA可编程逻辑元件实现基于反馈调控机制的区室间时空重组和可控信号通信。
近日,该研究工作以“Programmable DNA Nanocages Enable Adaptive Spatiotemporal Organization of Biomimetic Organelle Networks”《可编程DNA纳米笼实现仿生细胞器网络的自适应时空组织》为题在国际权威期刊《德国应用化学》(Angewandte Chemie International Edition)上在线发表。西安交大生命学院及生物医学信息工程教育部重点实验室为该论文第一作者单位和通讯作者单位,前沿科学技术研究院为共同通讯单位,赵永席教授和吴娜副教授为共同通讯作者,博士研究生郝鹏燕为第一作者。该研究得到了国家自然科学基金、陕西省创新能力支持计划等多个项目的共同资助,实验测试得到西安交大分析测试中心的大力支持。
论文链接:https://doi.org/10.1002/anie.202511909