蛋白质骨架是蛋白质正确折叠与功能发挥的核心。化学修饰作为研究蛋白质结构与功能以及开发治疗性生物偶联物的重要手段,一直以来备受关注。以往的研究多集中于蛋白质的侧链或末端修饰,尽管骨架在蛋白质结构与功能中占据核心地位,但其在生理条件下的选择性化学修饰仍面临巨大挑战。自然界常通过翻译后修饰在骨架中引入环结构,以增强蛋白稳定性或赋予其荧光、酶催化活性等功能。但是,通过人为的化学手段在骨架中引入环结构仍然非常困难,一方面是由于主链酰胺键在生理条件下化学惰性强,难以活化,另一方面酰胺结构的高度相似性也使得在特定位点实现选择性修饰极具挑战。
针对上述问题,西安交通大学生命科学与技术学院孙晓龙团队提出了一种基于半胱氨酸选择性偶联的蛋白修饰策略,无需催化剂即可在温和条件下高效修饰蛋白骨架,实现蛋白质结构功能调控。团队开发了一种基于茚二酮烯共轭受体的两步反应的策略(图1a):首先,小分子共轭受体通过与硫醇的迈克尔“加成-消除”反应,实现与半胱氨酸残基的快速特异性结合;随后,中间产物进一步发生分子内环化,与相邻酰胺键形成五元杂环结构。该反应在水体系中进行,无需催化剂或加热,并伴随荧光开启,具有优异的化学选择性和位点特异性。
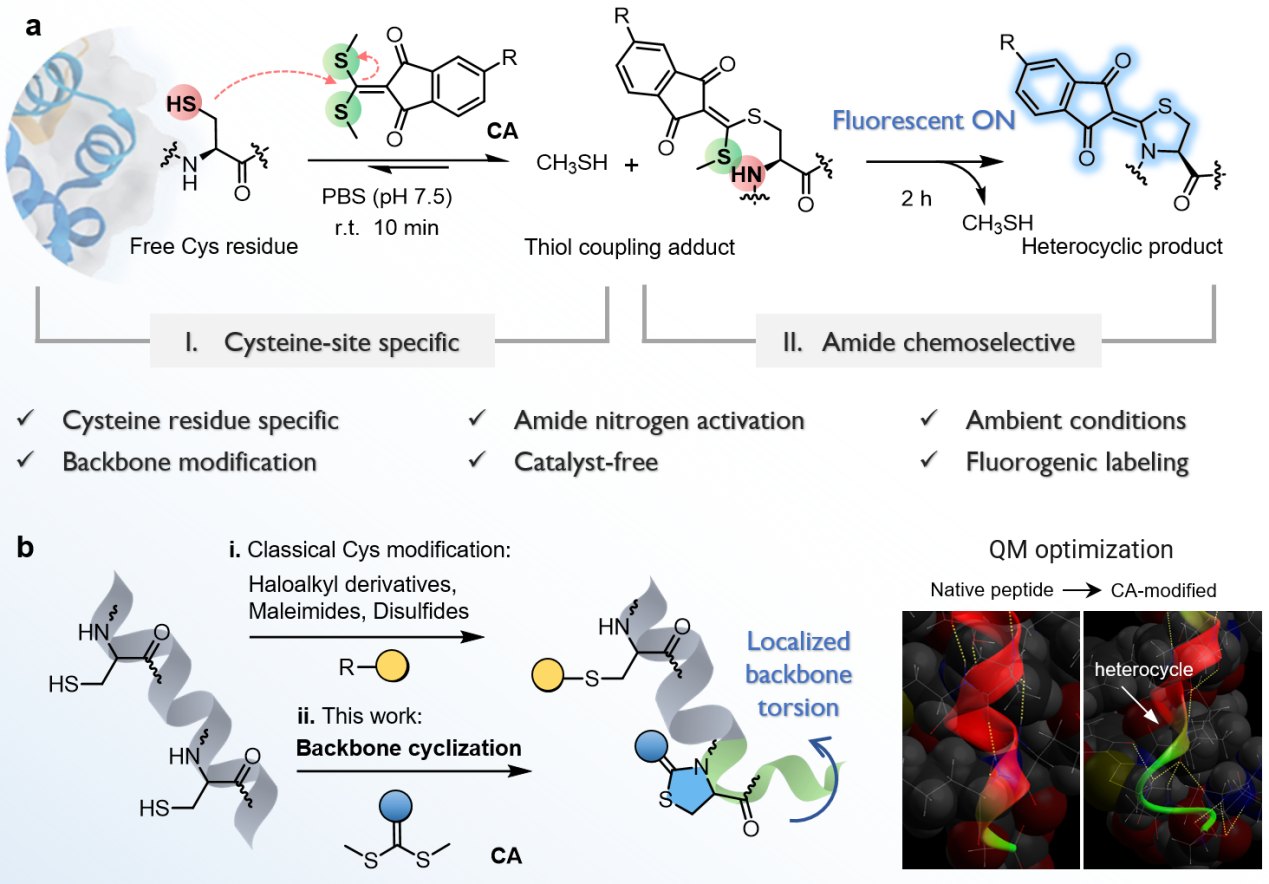
图1.(a)共轭受体对蛋白质骨架的两步修饰策略;
(b)区别于传统的侧链修饰手段,骨架环结构的引入调控蛋白折叠。
研究通过分子动力学模拟发现,该修饰会引起主链局部构象扭转、氢键断裂和侧链取向改变,进而影响蛋白质折叠行为(图1b)。初步实验表明,该修饰会改变蛋白质的热稳定性和酶活性。此外,该修饰过程伴随明显的荧光开启信号,使得反应能够实时、原位监测,为后续研究与应用提供了便利。这一方法不仅为蛋白质主链的特异性化学修饰开辟了新途径,也在蛋白质功能研究、荧光标记及新型生物偶联物开发方面展现出广泛的应用潜力。该技术已在半胱氨酸类似物、多肽和完整蛋白质体系中得到验证,显示出良好的普适性和可操作性,有望推动化学生物学和生物制药领域的创新进展。
该研究成果以《蛋白质半胱氨酸残基的位点特异性环化与荧光标记:从侧链到骨架》(Site-Specific Chemoselective Cyclization and Fluorogenic Modification of Protein Cysteine Residues: From Side-Chain to Backbone)为题发表在化学材料领域国际顶级期刊《美国化学会志》(Journal of the American Chemical Society)上。该工作是团队在长期坚持茚酮烯功能染料分子原创性开发与蛋白质荧光标记及修饰应用导向基础研究的又一项重要突破。文章第一作者为张慧助理教授,通讯作者是孙晓龙,该工作同时受到钱旭红院士的悉心指导。西安交通大学生命科学与技术学院生物医学信息工程教育部重点实验室为唯一通讯单位。以上工作受到国家自然科学基金、中央党校基本科研业务费、中国博士后基金、陕西省博士后基金、陕西省自然科学基金等资助支持,同时得到了西安交通大学分析测试中心的技术支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.5c08837
孙晓龙教授课题组主页:https://gr.xjtu.edu.cn/en/web/xs2759