皮肤鳞状细胞癌是全球第二常见的皮肤恶性肿瘤,其发病率随人口老龄化、紫外线暴露增加及免疫抑制人群扩大而持续上升。据预测,未来五年内皮肤鳞状细胞癌相关死亡人数可能超过黑色素瘤,防控形势日益严峻。此背景下,对其肿瘤微环境的深入理解至关重要。当前研究深入揭示了适应性免疫在塑造免疫抑制性微环境中的作用。然而,作为固有免疫的重要组分,肥大细胞在该过程中的具体机制尚不明确,尤其其是否主动参与肿瘤调控仍是关键科学问题。

针对这一挑战,西安交通大学第二附属医院皮肤病院耿松梅教授团队聚焦皮肤鳞状细胞癌免疫微环境并开展系统性探索。2025年11月,西安交通大学第二附属医院皮肤病院耿松梅教授团队在《研究性皮肤病学杂志》(Journal of Investigative Dermatology)上发表了题为《MAS相关GPR家族成员X2介导的肥大细胞活化通过白细胞介素17A释放促进皮肤鳞状细胞癌恶性进展》(MRGPRX2-Mediated Mast Cell Activation Promotes Malignant Progression of Cutaneous Squamous Cell Carcinoma via IL-17A Release)的重要研究成果。该研究首次揭示皮肤鳞状细胞癌肿瘤微环境通过重塑肥大细胞增殖及活化表型,驱动其释放白细胞介素17A,进而促进肿瘤恶性进展的关键作用机制,为皮肤鳞状细胞癌的免疫靶向治疗提供了新的理论依据与潜在靶点。
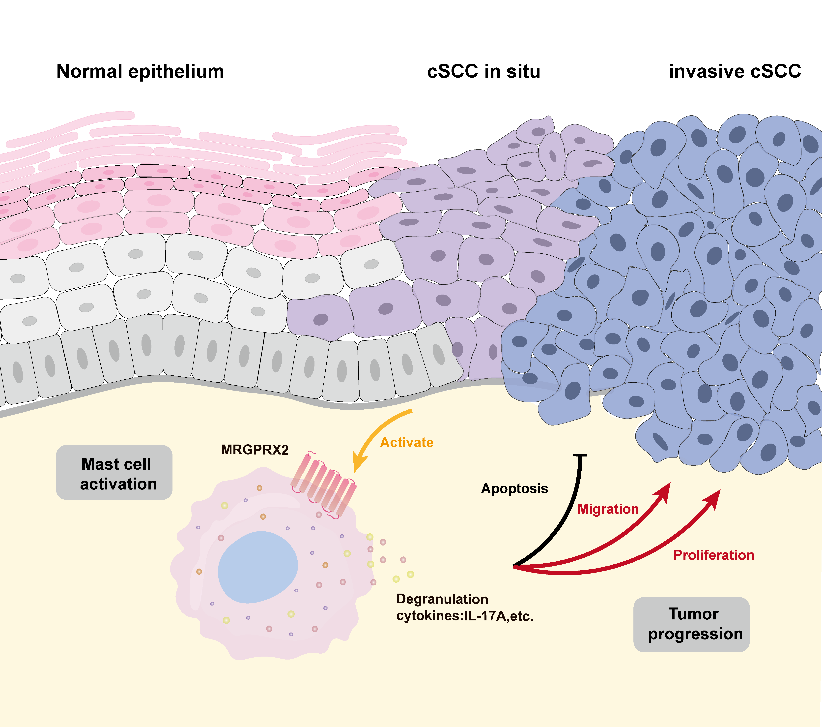
该研究综合运用临床组织分析、单细胞转录组测序、体外共培养模型及体内动物实验,获得以下主要发现:生物信息学及临床样本分析发现皮肤鳞状细胞癌皮损存在肥大细胞增多及活化,且与患者不良预后显著相关。单细胞测序分析首次破译了皮肤鳞状细胞癌微环境中肥大细胞异质性,鉴定出一类具有原位增殖能力的独特亚群。功能实验证实,肿瘤细胞来源的信号通过诱导增殖表型,主动“驯化”肥大细胞以实现其原位扩增的新范式。研究首次明确提出肥大细胞是皮肤鳞状细胞癌微环境中白细胞介素17A的主要细胞来源,这一发现突破了传统认为T细胞或中性粒细胞是主要来源的认知。机制上,活化的肥大细胞通过释放白细胞介素17A,构建了一个关键的促癌信号轴,直接促进了肿瘤的增殖、侵袭与生存能力。在皮肤鳞状细胞癌中阐明了一条由MAS相关GPR家族成员X2介导肥大细胞活化新通路。靶向该通路能有效抑制后续致癌信号的启动,为干预肿瘤免疫微环境提供了全新靶点与治疗思路。该研究系统阐释了MAS相关GPR家族成员X2–肥大细胞–白细胞介素17A信号轴在皮肤鳞状细胞癌恶性进展中的核心作用。该创新发现不仅深化了对皮肤鳞状细胞癌免疫微环境的理解,也为靶向MAS相关GPR家族成员X2/白细胞介素17A轴的免疫治疗策略提供了理论依据和实验支持。
西安交通大学第二附属医院皮肤科周彤、冯雨晴为本论文的共同第一作者,耿松梅教授为通讯作者。项目获陕西省创新能力支撑计划、中央高校基本科研业务费专项、陕西省重点产业创新链项目及国家重点研发计划联合资助。
耿松梅教授团队长期深耕皮肤疾病免疫微环境领域,团队近年取得了一系列具有国际影响力的成果,不仅在国际权威期刊发表SCI论文50余篇,更深入揭示了MRGPRX2受体在类过敏、慢性荨麻疹及特应性皮炎等炎症性皮肤病中的关键作用。此次对皮肤鳞状细胞癌的深入研究,是该科研脉络的延续与重要拓展。近年来,耿松梅教授作为共同通讯组织全国相关领域专家撰写《皮肤鳞状细胞癌诊疗专家共识》等皮肤肿瘤、罕见皮肤病等共识指南,积极推动基础研究成果向临床诊疗实践的转化。