细胞膜具有显著异质性,其局部分子组成和生物物理特征呈现多样性,这种固有异质性形成了多种功能性微区。其中,脂筏(Lipid raft, LR)是由胆固醇和鞘脂富集形成的动态微区,尺寸约10-200 nm,具有独特的脂质与蛋白组成。通过脂质之间、脂质与蛋白之间的相互作用,细胞膜被划分为脂质有序域(lipid-ordered, Lo)或脂质无序域(lipid-disordered, Ld),形成横向异质性分布。脂筏属于脂质有序域,可作为蛋白聚集和信号传导的分子平台,非脂筏区则参与膜流动等基础生物物理过程。
生物分子在不同细胞微区中的时空分布,对维持正常的细胞过程至关重要。传统荧光显微成像技术存在光学行射极限(约200-400),不能区分生物分子在细胞膜微区的时空分布。超分辨荧光显微技术突破衍射极限,可以实现约10-100 nm空间分辨。另一方面,超分辨显微设备要求高、操作复杂、对普通用户不友好,且容易产生漂移误差,导致信号定位不准确。
近日,西安交通大学赵永席教授团队发展了一种名为定位区分DNA分级循环构筑(Location-Differentiated DNA Hierarchical Cyclic Construction)的细胞成像技术,解析活细胞膜脂筏内外两种微环境中同种生物分子的时空分布信息。该方法主要是基于课题组前期发展的DNA邻近编码识别原理,并引入分级编码概念,利用DNA分子探针的纳米级别长度可调、动态可编码链式杂交与循环酶切等特性,将不同细胞膜微区中的同种生物分子,标记转化为不同种荧光信号。因此,根据荧光信号种类不同,即可观测同种生物分子在不同微环境的时空分布,无需超分辨显微成像。为了验证该方法的普适性,研究团队分别检测细胞膜上的蛋白分子与RNA分子。利用该方法解析了多种肿瘤细胞与衰老细胞模型中表面蛋白受体在脂筏内外的时空分布,分析了该方法在探索其他细胞膜微区或亚细胞结构(如线粒体、内质网)的应用前景,并讨论了与超分辨显微成像强强联合的可能性。
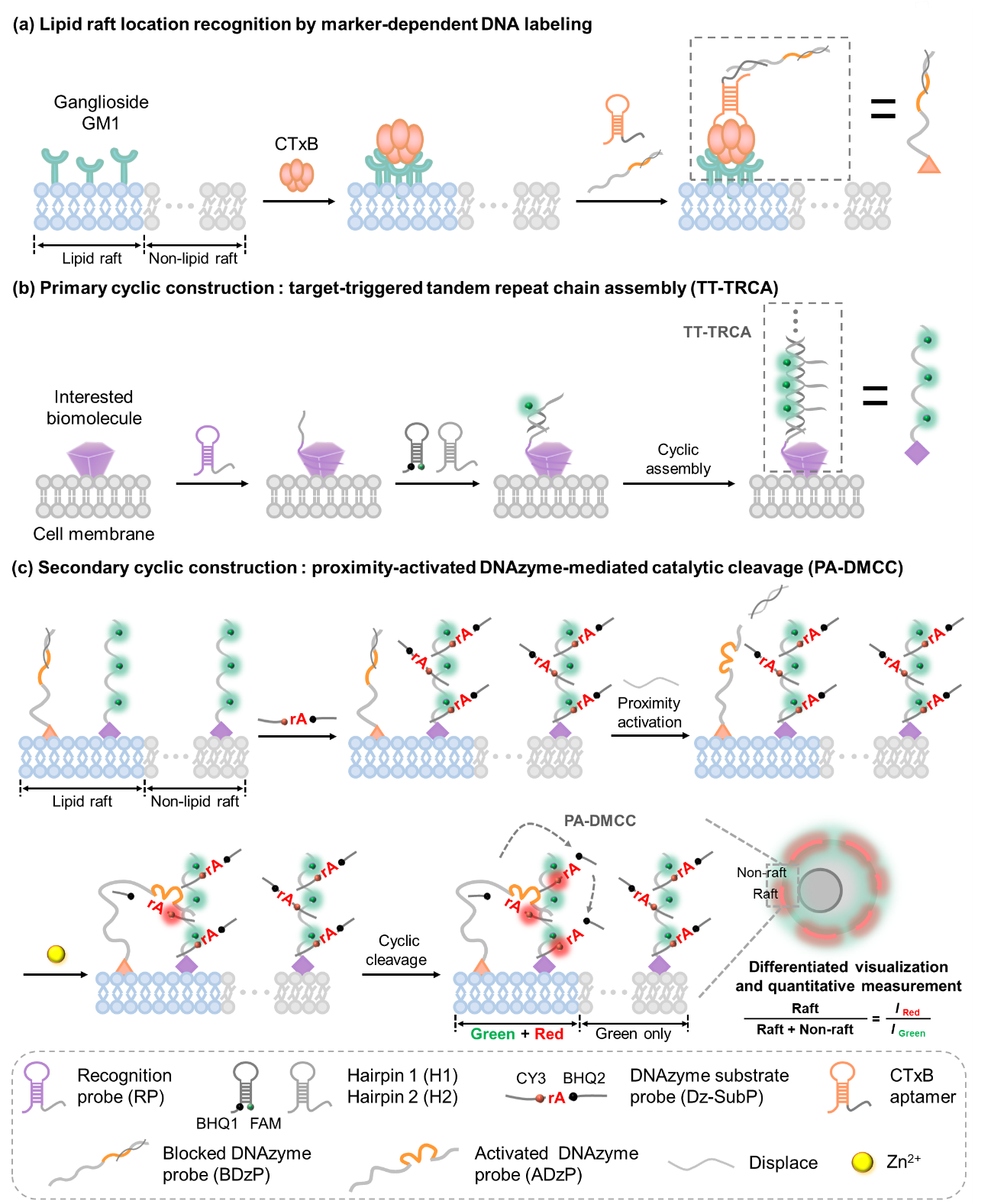
定位区分DNA分级循环构筑成像方法。(a)分子探针定位标记脂筏标志物。(b)初级DNA循环构筑,将脂筏内外同种分子都转化为第一种荧光信号。(c)次级循环构筑,将脂筏内的目标分子转化为第二种荧光信号。
该研究工作以“Location-Differentiated DNA Hierarchical Cyclic Construction Demarcating Identical Biomolecules Across Cell Membrane Microenvironments”(定位区分DNA分级循环构筑成像划分细胞膜微环境中同种生物分子)为题在国际权威期刊《德国应用化学》(Angewandte Chemie International Edition)上在线发表。西安交大生命学院生物医学信息工程教育部重点实验室为该论文的第一作者单位和通讯作者单位,前沿科学技术研究院为共同通讯单位,赵永席教授和陈锋教授为共同通讯作者,硕士研究生李竹和博士研究生李欣音为共同第一作者。该研究得到了国家自然科学基金、陕西省自然科学基金等多个项目的共同资助,实验测试得到西安交大分析测试中心的大力支持。
上述工作是该团队在DNA编码单细胞分析领域的又一重要成果,前期建立的系列DNA编码分析方法已发表在《自然-实验手册》(Nature Protocols)、《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)、《自然-通讯》(Nature Communications)、《美国化学会志》(Journal of the American Chemical Society)、《德国应用化学》(Angewandte Chemie International Edition)、《核酸研究》(Nucleic Acids Research)等期刊。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202505249
赵永席教授研究团队主页链接:
http://gr.xjtu.edu.cn/web/yxzhao