近年来,以免疫检查点抑制剂(ICIs)为代表的免疫治疗改变多种晚期肿瘤的治疗模式,并给患者带来了显著的生存获益。然而,目前获得性耐药与免疫相关不良反应(irAEs)是限制ICIs治疗效果的重要原因。
为探讨ICIs获得性耐药的潜在机制,一附院何旺骁团队从黑色素瘤免疫治疗样本出发,发现分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA)在黑色素瘤中的活性远高于其他肿瘤类型。此外,在转移性黑色素瘤中,CMA与PD-L1表达水平显著正相关,这与抗PD1获得性免疫耐药(AIR)密切相关。通过PD1抗体诱导的小鼠耐药模型,研究团队进一步发现,这种相关性是由IFN-γ介导的PD-L1和CMA补偿性上调引起的,并伴随巨胞饮作用的显著增强。因此,通过依赖巨胞饮作用的CIP重新调控CMA,促进PD-L1降解,可能是重新激活抗癌免疫的一种有前景的策略。
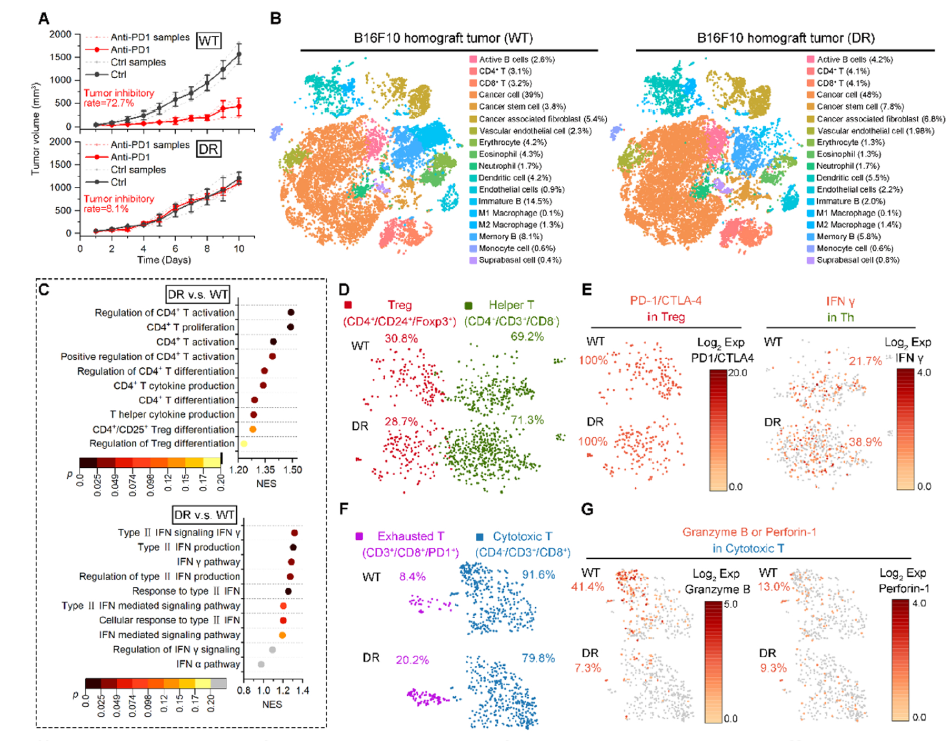
在此基础上,研究团队通过GSH调控的可逆自组装,基于手性多肽PHA巧妙地设计了类朊病毒微蛋白药物SAP,以重新调控CMA,使其能够识别PD-L1并诱导其通过溶酶体途径降解。研究发现,SAP通过PD-L1促进的巨胞饮作用有效且选择性地被黑色素瘤细胞内化,随后在肿瘤细胞中选择性地减少了PD-L1的丰度。因此,SAP在抗PD1诱导的AIR黑色素瘤小鼠模型中恢复了抗肿瘤免疫力,并在人源化患者来源的异种移植(Hu-PDX)黑色素瘤小鼠模型中展示了令人满意的治疗效果,同时保持了良好的安全性。总体而言,SAP不仅提出了一种具有临床转化潜力的免疫重新激活策略,可以克服黑色素瘤的免疫治疗耐药,同时该研究还为精准医学指导的药物开发提供了一个典范。


该工作以《朊病毒样化学诱导剂可重构CMA以在癌症中对抗适应性免疫抵抗》( Rewiring chaperone-mediated autophagy in cancer by a prion-like chemical inducer of proximity to counteract adaptive immune resistance )为题在著名期刊《药物耐药进展》( Drug Resistance Updates )上发表。西安交通大学第一附属医院何旺骁研究员为文章通讯作者,西安交通大学闫瑾研究员与西安交通大学第一附属医院肿瘤内科刘丹博士为本文第一作者。该文章Online后即成为ESI热点论文。
为避免免疫相关不良反应(irAEs)的发生,尤其是避免检查点抑制剂相关性肺炎(CIP)在肺癌免疫治疗中的发生,突破合并间质性肺疾病(ILD)在肺癌ICIs治疗的“禁区”,研究团队基于仿生纳米医学策略开发了一种新型的红细胞膜(RBC)膜仿生超分子ICI类蛋白—EMS-PDBP,用于合并IPF肺腺癌的免疫治疗。EMS-PDBP可以基于肿瘤细胞、巨噬细胞和肺成纤维细胞独特的内吞机制,选择性靶向肿瘤细胞PD-L1,从而实现合并IPF肺腺癌的精准免疫治疗。该团队首先通过Au-S配位无限自组装作用,基于PD-L1结合多肽(PDBP)合成超分子ICI类蛋白S-PDBP。进一步通过RBC膜修饰技术合成EMS-PDBP。
研究发现红细胞膜修饰后EMS-PDBP在肿瘤细胞中的内吞方式从巨胞饮转变为小窝蛋白介导的内吞作用,从而进一步提高其对肿瘤细胞的选择性和靶向性,为精准抑制肿瘤细胞PD-L1奠定了良好的基础。研究结果表明,EMS-PDBP在肺腺癌原位移植瘤小鼠模型(LC)和肺腺癌荷瘤IPF原位移植瘤小鼠模型(LC-PF)中具有强大的抗肿瘤免疫能力,通过靶向抑制肿瘤细胞PD-L1蛋白表达水平,逆转抑制性肿瘤免疫微环境(TIME),从而恢复细胞毒性T淋巴细胞(CTLs)对肿瘤细胞的杀伤作用。重要的是,EMS-PDBP不会增加LC及LC-PF小鼠各个系统irAEs,尤其是CIP的发生。
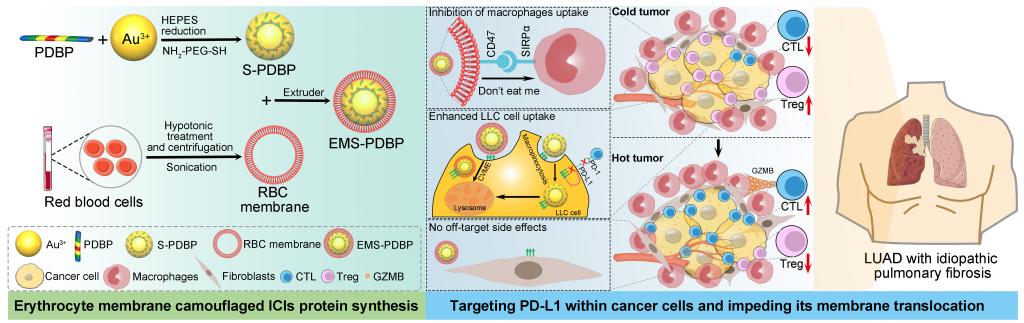
该工作以《通过具有选择性内吞作用的仿生类蛋白推进合并特发性肺纤维化肺腺癌免疫治疗的界限》(Advancing the boundaries of immunotherapy in lung adenocarcinoma with idiopathic pulmonary fibrosis by a biomimetic proteinoid enabling selective endocytosis )为题在美国化学会旗下顶级期刊 《《美国化学会纳米》》(ACS Nano)上发表。西安交通大学第一附属医院何旺骁研究员为文章通讯作者,肿瘤内科蒋爱民博士为文章第一作者。
论文链接:
https://www.sciencedirect.com/science/article/pii/S1368764623001206?via%3Dihub=
https://pubs.acs.org/doi/10.1021/acsnano.3c09852