手性与生命现象密切相关,天然氨基酸、单糖及蛋白质、DNA等多以单一手性形式存在。目前市售和在研的小分子药物中超过60%都带有手性中心。α-手性羧酸广泛存在于生物活性分子中,更是一大类非甾体抗炎药的关键骨架。目前工业中α-手性羧酸的合成主要采用不饱和酸的不对称氢化,存在原料不易得,使用贵金属催化剂及高压设备的局限。近年来,以二氧化碳为试剂的羧基化反应吸受到关注并取得进展,但主要集中在消旋反应,尚不能有效获得单一手性产物。若能以易得原料和二氧化碳一步直接合成手性羧酸药物,将具有潜在的重要工业价值。
在金属催化不对称反应中手性配体是调控催化剂活性和立体选择性的关键因素。针对领域内长期存在的手性吡啶配体设计难题,前沿院李鹏飞课题组借鉴细胞色素P450等酶结构特征,提出“双层位阻调控”策略。通过多年深入研究,建立了一类结构高度可调、“内松外紧”的新骨架手性吡啶单元,从而更有效调控反应的活性与选择性。课题组前期采用包含此单元的N,B-双齿配体,实现了高选择性的不对称C-H硼化反应,接着利用进一步发展的手性联吡啶配体SBpy成功实现了镍催化不对称还原加成反应和不对称还原自偶联反应。
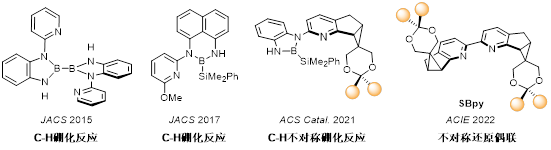
李鹏飞课题组设计的系列吡啶衍生配体
最近,课题组利用独特的手性联吡啶配体发展了苄基卤化物以及季铵盐与常压二氧化碳之间的不对称羧基化反应,利用廉价金属镍催化剂,在温和条件下合成了一系列具有重要价值的手性羧酸类化合物。该反应无需使用预制备的有机金属试剂以及有害气体和高压装置。该反应的关键在于手性2,2'-联吡啶配体SBpy的使用。考虑到手性酸的普遍存在和转化的多样性,该反应可以为众多生物活性分子的合成提供新手段。同时,工作进一步展示了这类联吡啶配体在催化中的适用性,为发展更多具有工业价值的不对称反应提供了新配体工具。
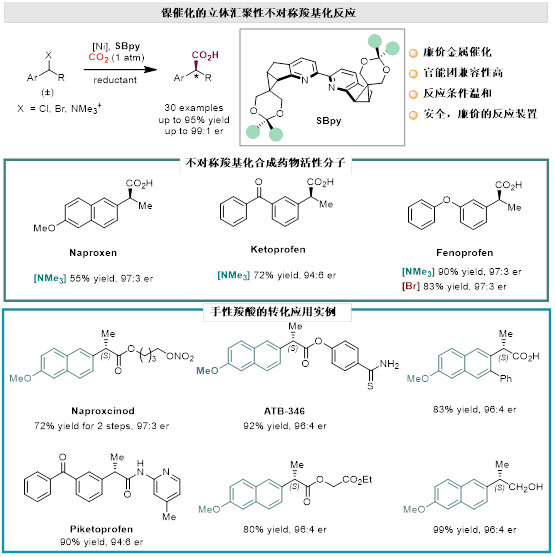
该研究成果日前发表于国际化学领域权威期刊《德国应用化学》(Angewandte Chemie International Edition)。论文第一作者为西安交通大学前沿院博士研究生王凌华,通讯作者西安交大青年拔尖人才计划入选者、前沿院教授李鹏飞。
论文链接:
https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202213943
李鹏飞教授课题组主页:
https://gr.xjtu.edu.cn/en/web/lipengfei/home