不可按压出血是战场与严重创伤中可预防性死亡的首要原因。在深部躯干或交界区域(如腹股沟、腋窝),由于伤口解剖位置复杂、无法实施有效压迫,常规止血手段往往失效,导致极高的死亡率。现有临床前沿的可注射膨胀止血材料,如美国军方采用的XStat™(压缩纤维素海绵)和ResQFoam(原位发泡制剂),虽能通过物理膨胀堵塞伤腔,但仍存在显著局限:XStat™缺乏主动的生化促凝功能,且其移除过程复杂;ResQFoam则操作繁琐,对使用者的专业性要求高,误用风险大。这些材料的共同短板在于,其止血机制相对单一(主要依赖物理堵塞),难以在面临大量、活跃的动脉出血时实现快速、牢固的止血密封。
针对上述挑战,并基于课题组在可注射、可膨胀止血材料方面的长期积累(Nature Reviews Chemistry, 2021, 5(11): 773-791;Nat. Commun. 2018, 9, 2784; Adv. Mater. 2024, 36, 2308701; National Science Review, 2022, 9(11): nwac162; Biomaterials, 2025, 315: 122936),西安交通大学前沿院郭保林教授团队提出了全新的材料设计范式:将“便携粉末的储存稳定性”、“液态材料的渗透与贴合性”以及“固态凝胶的强韧粘附性”三者优势合而为一。团队成功研制出一种超快速自凝胶、自膨胀、自推进、高粘附的促凝止血粉末。该粉末以聚乙烯亚胺(PEI)和聚丙烯酸(PAA)形成的超快物理交联网络为核心,引入多巴胺修饰的蒙脱土(PDA-MMT)以显著增强湿态组织粘附力;更关键的是,创新性地将质子化氨甲环酸(TXA-NH₃⁺)与碳酸钠(Na₂CO₃)组成的发泡体系集成于粉末中,使其在接触血液的瞬间(2秒内)不仅快速凝胶化,更能通过持续的酸碱反应释放二氧化碳气体,驱动材料实现高达400%的体积膨胀和自主推进,从而主动填充并封闭不规则深部出血位点(图1)。该材料的止血机制是一种卓越的多重协同:1)物理密封:快速凝胶与自主膨胀即时在破裂血管处形成高强度的物理屏障;2)生化促凝:材料高效富集血液中的凝血因子、激活血小板与红细胞,同时释放的氨甲环酸(TXA)强力抑制纤维蛋白溶解,从多个通路加速并稳固天然凝血过程;3)强效粘附:基于儿茶酚化学的湿粘附作用,确保凝胶屏障即使在血流冲击下也能与周围组织紧密贴合,耐受超过400 mmHg的爆破压力(远高于人体收缩压)。
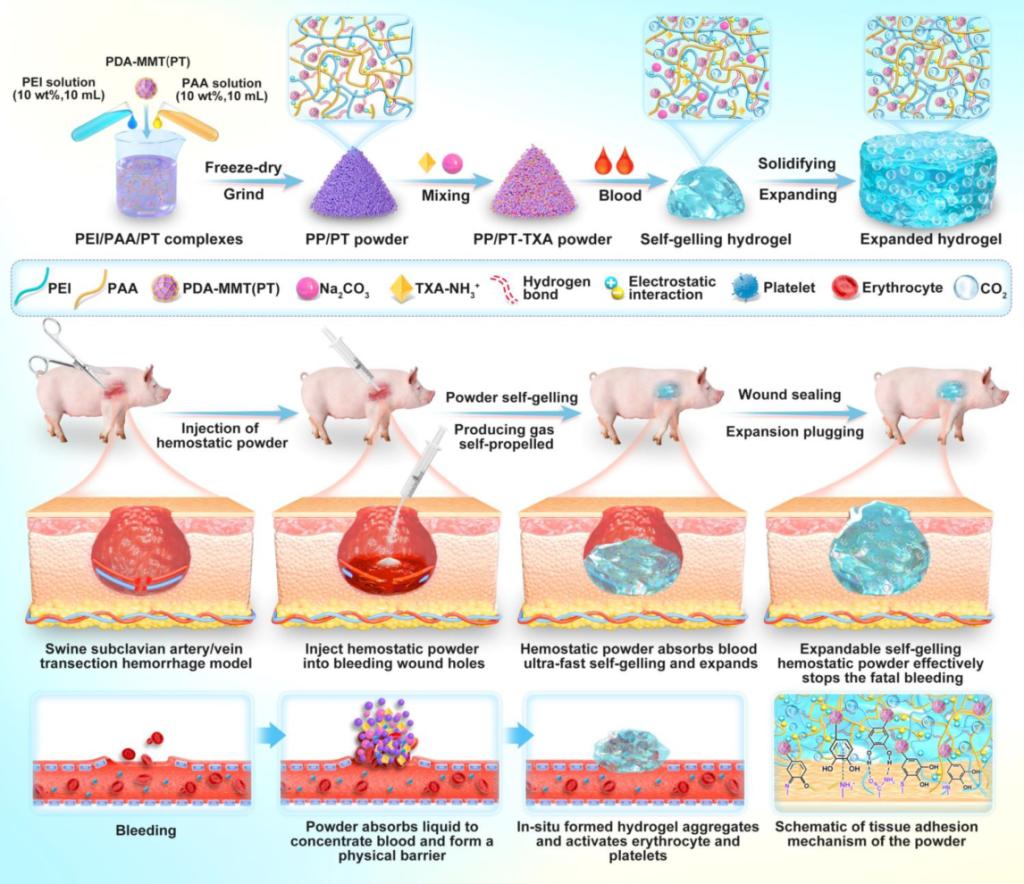
图1. 止血粉末的制备、应用及作用机制示意图。本图展示了具有增强凝血功能的快速自凝胶、自膨胀、自推进及高粘附性止血粉末的制备示意图,以及将该粉末注射至猪锁骨下动脉/静脉横断出血模型的应用流程图,并附有其相应的促凝血与粘附机制示意图。
在系统性的动物实验中,该止血粉末展现了颠覆性的止血效能。在大鼠肝脏缺损和股动脉完全离断模型中,其止血时间和失血量均显著优于商业壳聚糖止血粉。在致死性兔锁骨下动静脉完全离断不可按压出血模型中,止血成功率达100%,失血量减少90%。最为突出的成果出现在与临床最为接近的猪致死性锁骨下动静脉完全离断不可按压出血模型中:与需要持续手工压迫的医用纱布对照组相比,优化后的止血粉末在无需任何额外压迫的情况下,将失血量降低了98%(从591.7 mL降至11.7 mL),并将止血时间缩短了96%(从33 min缩短至1.2 min),所有实验猪均存活。其综合性能也超越了美军已列装的XStat™。此外,该粉末还具备优异的抗菌性、生物相容性,并能促进皮肤切口愈合。
这项工作不仅为解决不可按压大出血这一世界性难题提供了一种极富前景的创新性解决方案,其“粉末-凝胶-自膨胀”的新型转化策略,更为下一代便携式、自适应、多功能急救止血材料的开发开辟了新方向。该成果以“超快速自胶凝、自膨胀、自推进高黏附促凝止血粉用于非压迫性出血止血研究”(Ultra-fast self-gelling self-expanding self-propelling high-adhesion procoagulant hemostatic powder for non-compressible hemorrhage hemostasis in pigs)为题发表于《自然·通讯》(Nature Communications)。文章通讯作者为西安交通大学郭保林教授。西安交通大学黄晟飞硕士和西安交通大学口腔医(学)院李勐副研究员为文章的共同第一作者。该研究得到了国家自然科学基金、陕西省科技计划等项目资助。
论文链接: https://doi.org/10.1038/s41467-026-68683-y