肝脏是转移性胃肠癌细胞定居和生长的常见部位,肝转移癌目前的治疗选择非常有限,是导致患者死亡率高的主要原因之一。肝星状细胞(Hepatic stellate cell,HSC)是促转移性肝脏微环境的一个关键组分,其通过转化生长因子-β(Transforming growth factor-β, TGF-β)依赖性机制转分化为促肿瘤的肌成纤维细胞(Myofibroblasts,MFs),活化的HSC/MFs通过旁分泌机制调节肝转移癌生长,包括释放生长因子、细胞因子、细胞外基质和基质金属蛋白酶。了解除TGF-β之外的控制HSC活化的关键分子和通路,将有利于开发针对肝脏肿瘤微环境的抗肝转移癌新策略。
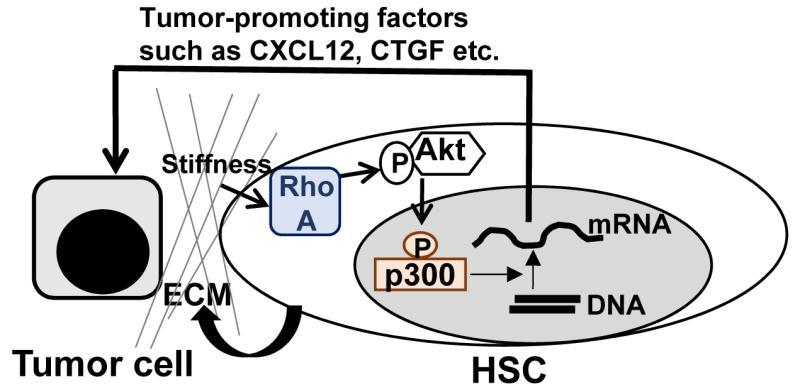
近日,西安交通大学第一附属医院肝胆外科刘青光教授研究团队和美国明尼苏达大学荷美尔研究所(Hormel Institute, University of Minnesota)Ningling Kang教授研究团队以及美国梅奥医学中心胃肠研究室(GI Research Unit, Mayo Clinic)Vijay H. Shah教授研究团队共同合作,创新性地发现高基质硬度诱导HSC活化以及P300核内蓄积,P300在高基质硬度诱导的HSC活化中发挥关键调控作用。高基质硬度通过激活RhoA-Akt信号诱导P300磷酸化(Ser1834)并随后促进P300核内蓄积,P300通过表观遗传修饰促进一系列转移促进因子表达,如趋化因子12(C-X-C motif chemokine ligand 12,CXCL12)。该研究为肝脏肿瘤微环境中HSC促进肿瘤转移性生长提供了新的分子机制,也为减少肿瘤在肝脏种植和转移性生长提供了潜在的治疗靶点。
该研究成果近期发表在胃肠病学和肝病学研究领域顶级期刊Gastroenterology(影响因子为18.392),论文题目为“P300 Acetyltransferase Mediates Stiffness-Induced Activation of Hepatic Stellate Cells Into Tumor-promoting Myofibroblasts”。西安交通大学第一附属医院肝胆外科窦常伟博士、刘志奎博士、涂康生副研究员为该文章的共同第一作者,西安交通大学第一附属医院是该文章的第二单位。近年来,刘青光教授致力于肝癌肿瘤微环境的基础-临床-转化研究及学科建设,注重研究生临床和科研思维的训练、培养,采取先临床实习后基础研究的培养模式,取得了多项具有临床应用前景的科研成果。
相关链接:http://www.gastrojournal.org/article/S0016-5085(18)30209-9/fulltext
https://www.ncbi.nlm.nih.gov/pubmed/29454793