肥胖作为2型糖尿病、心血管疾病及癌症等众多疾病的危险因素,已成为世界公认的公共卫生问题。在肥胖症中,脂肪组织发生动态重塑,包括体积增大(肥厚)和脂肪细胞数量增加(增生),免疫细胞浸润,以及组织纤维化的发展,同时已有数据证实,肥胖期间脂肪细胞死亡明显增加。然而,人们对在肥胖期间保护脂肪细胞不受控制的细胞死亡的机制仍知之甚少。
近日,西安交通大学医学部基础医学院心血管研究中心王胜鹏教授作为共同通讯作者与德国马普所Stefan Offermanns院士组合作在 Nature Communications(自然-通讯)发表论文“YAP and TAZ protect against white adipocyte cell death during obesity”。 为了检测肥胖过程中白色脂肪细胞的YAP和TAZ活性是否受到影响,作者检测了YAP和TAZ的亚细胞定位以及YAP/TAZ靶基因在人和小鼠白色脂肪细胞中的表达,并证明人类和小鼠的肥胖伴随着白色脂肪细胞中YAP和TAZ的激活增加。
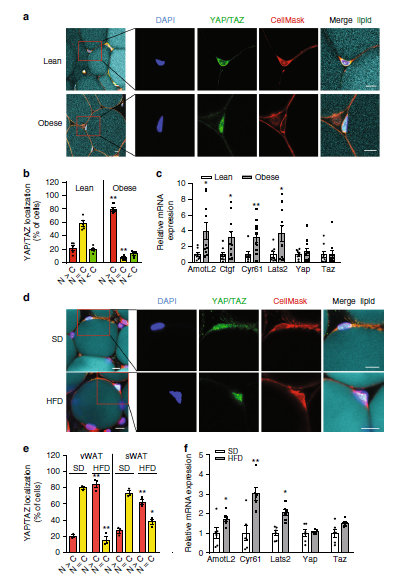
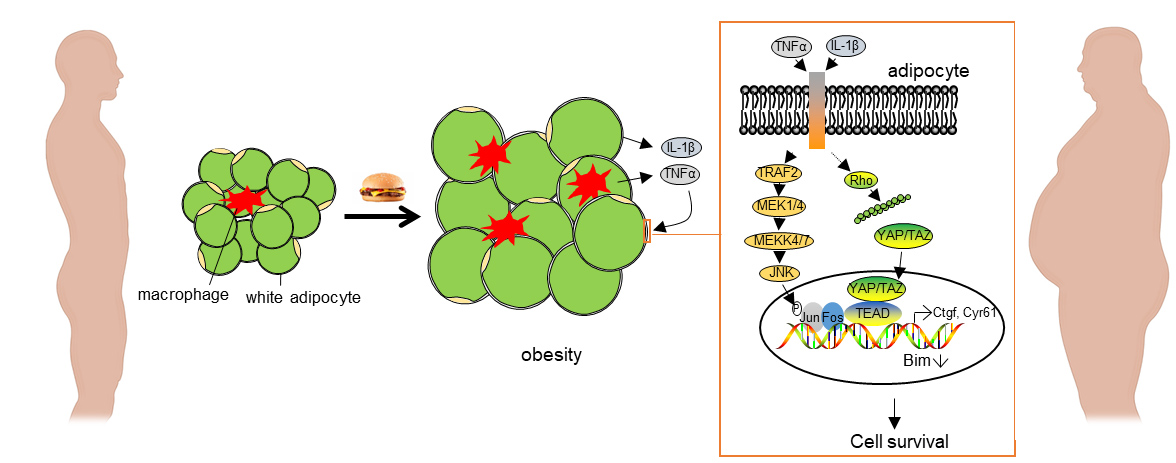
为了研究YAP和TAZ在白色脂肪细胞中的作用,团队将携带YAP和TAZ等位基因(Yapfl/fl;Tazfl/fl)的小鼠与Adipoq-CreERT2小鼠系杂交,得到了可诱导的脂肪细胞特异性YAP和TAZ缺陷小鼠。在正常饮食条件下,iAd-Yap/Taz-KO小鼠与野生型小鼠相比,其总体重、葡萄糖耐量或脂肪量均无差异。为了测试在肥胖期间激活YAP和TAZ是否影响脂肪细胞功能,iAd-Yap/TazKO小鼠喂食高脂饲料(HFD)。经过12周的HFD喂养,iAdYap/Taz-KO小鼠的体重明显低于野生型。两组小鼠的空腹血糖水平相似,但iAd-Yap/Taz-KO小鼠的葡萄糖耐量较野生型小鼠有所提高。与野生型同窝鼠相比,iAd-Yap/Taz-KO小鼠的内脏WAT (vWAT)和皮下WAT (sWAT)明显减少。这些变化在单独诱导脂肪细胞特异性缺失YAP或TAZ的小鼠中没有观察到,说明这两种转录调节因子在脂肪细胞中具有重叠的功能。iAd-Yap/Taz-KO小鼠的脂肪细胞形态和平均细胞大小没有变化,但内脏和sWAT小鼠的脂肪细胞总数明显减少。作者还在iAd-Yap/Taz-KO小鼠的WAT中发现了更多的冠状结构和巨噬细胞,以及通过TUNEL法测定的凋亡细胞数量。这些数据表明,在肥胖期间,YAP和TAZ的丢失导致脂肪细胞死亡的增加。总之,脂肪细胞特异性YAP和TAZ缺乏是导致肥胖期间脂肪细胞死亡增加的原因,以YAP/TAZ信号为靶点可能提供一种新的治疗策略,通过减缓高热量饮食中白色脂肪的膨胀来治疗肥胖。
该研究得到西安交通大学青年拔尖人才计划、国家自然科学基金、科技部基金、陕西省杰出青年科学基金等项目的资助。得到第一附属医院袁祖贻教授、医学部实验动物中心刘恩岐教授等的大力支持。
王胜鹏课题组长期从事血管及代谢疾病的力学生物学研究,在机械力感知受体发掘及机械信号转导方面做出了一系列原创工作。王胜鹏教授作为通讯作者于2020年5月在Nature Communications(自然-通讯)发表论文“Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway”,首次揭示了脂肪细胞感知机械力学信号的关键蛋白Piezo1, 该高水平系列成果的发表,为肥胖发病的力学机制及脂肪细胞凋亡研究拓展了新的研究领域和方向。
论文链接: https://www.nature.com/articles/s41467-020-19229-3