生物正交剪切化学(bioorthogonal cleavage chemistry,BCC)在肿瘤成像与疾病监测中逐步展现出独特优势,尤其在荧光探针领域已取得显著进展。然而,传统荧光成像依赖外源激发光,常面临自体荧光干扰、光漂白、成像深度不足等限制。相比之下,化学发光(chemiluminescence,CL)技术因其无需外源激发、背景噪声低及信号穿透力强,近年来受到广泛关注,但现有化学发光探针在复杂体内环境中常存在选择性差、激活机制不明确、难以精准控光等关键难题,严重制约了其在生物医学领域的深入应用。
面对上述挑战,西安交通大学郭东男博士在导师王嗣岑教授与侯晓芳副教授指导下,联合西安交通大学化学学院以及一附院、二附院,成功开发了一种智能金属钌(Ru)催化的生物正交激活化学发光(bioorthogonal activation chemiluminescence,BAC)探针,通过将 BCC 策略与苯氧基-金刚烷基-1,2-二氧杂环丁烷骨架(PAD)整合,实现了对肿瘤微环境中与巯基失调相关的含巯基代谢物(如H2S)在体内的实时精准成像(图1)。
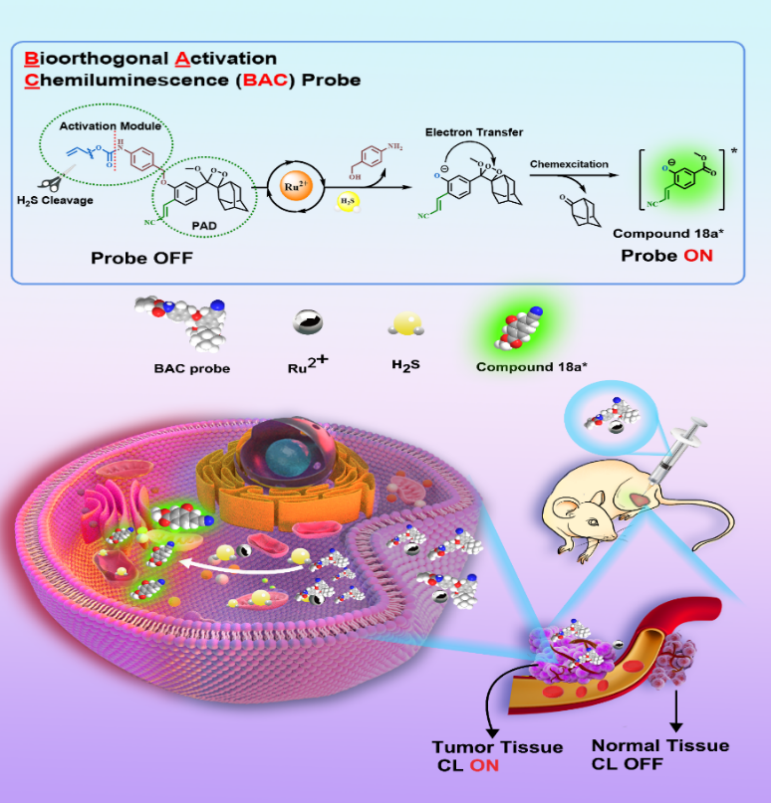
图1. 金属钌催化BAC探针在肿瘤组织中特异响应H₂S,实现“开/关”型信号调控与肿瘤可视化成像
该BAC探针通过“钌锁定”(Ru-locked)机制,突破性实现了对复杂肿瘤微环境中巯基的高选择性激活,有效克服了传统化学发光探针的诸多局限性。该机制具有快速响应(1 min)、高灵敏度(LOD=0.24 μM)和稳定发光(半衰期达 18.5 h)等优势,发光波长覆盖范围广(400~800 nm)。该探针在体内外均表现出对H₂S等含巯基代谢物的优异选择性,可在0~100 μmol/L范围内与H₂S浓度呈现良好的线性关系。
在乳腺癌小鼠模型中,该探针成功实现了对内源性 H₂S 的高精度可视化,展示出其在肿瘤定位和图像引导手术中的巨大潜力,具有良好生物相容性和靶向性。体内外实验均验证了该探针的低毒性,在常用浓度下对细胞存活率无显著影响,免疫组化结果未观察到明显毒副作用,进一步支持了其在活体成像和临床转化中的应用潜力。
此外,研究团队还优化了PAD骨架合成路线,将合成成本降低了300~400倍,产率由原来的40%提升至95%。这一优化使得探针合成从6步合成工艺简化成了1步,合成时间从14天缩短到了1天,大大提高了实验效率并具备规模化生产潜力。该探针在动物体内成像过程中表现出信号持续性强、背景干扰小的优势,在术中实时监测中具备良好应用前景,为巯基失调及相关病理过程的无创诊断与动态监测提供了全新的技术路径。
本研究首次构建了“钌催化+生物正交+化学发光”三位一体的激活体系,创新性地建立了一套全新的成像机制体系,为肿瘤代谢成像、氧化还原稳态监测及多种硫醇失衡相关疾病的研究与诊断开辟了新路径。该成果不仅对肿瘤分子成像具有重要意义,也为其他巯基相关疾病如神经退行性疾病、心血管疾病的精准诊断提供了新的思路与方法。

以上研究成果以题为“A Smart Ru-Locked Chemiluminescence Probe via Bioorthogonal Activation for Highly Selective, Real-time and Non-Invasive In Vivo Imaging of Thiol Dysregulation”(一种基于生物正交激活的智能钌锁定化学发光探针用于硫醇代谢紊乱的高选择性、实时、无创体内成像)发表在《Aggregate》(聚集体)期刊上。论文第一作者为西安交通大学药学院郭东男博士和胥丹博士,通讯作者为西安交通大学药学院王嗣岑教授与侯晓芳副教授。
论文链接:https://doi.org/10.1002/agt2.70076
王嗣岑教授课题组链接:https://gr.xjtu.edu.cn/en/web/wangsc